INGENIERÍA GENÉTICA Y SALUD VII.
PRESENTE Y FUTURO DE LA TERAPIA GÉNICA.
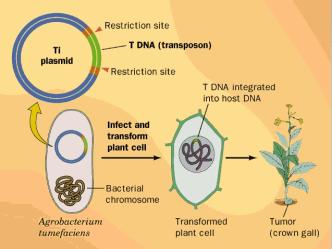
Más tarde, la ingeniería genética se planteó nuevos objetivos. Ya no sólo se trataría de obtener productos de los organismos genéticamente alterados, sino de alterar el crecimiento o las características de los propios organismos. También el objetivo ha sido ya alcanzado: existen plantas de temporada genéticamente alteradas que proporcionan cosechas todo el año, flores y frutos con olores y sabores de diseño, plantas resistentes a las heladas, las plagas o las sequías, plantas productoras de proteínas aptas para alérgicos al gluten, microorganismos productores de plásticos, bacterias digestoras de hidrocarburos, etc. Las posibilidades son ilimitadas.

Y hoy, en pleno siglo XXI, estamos a las puertas de alcanzar el objetivo más ambicioso: la terapia génica. Numerosas enfermedades humanas poseen un origen genético, es decir, el enfermo posee algún gen defectuoso que le priva de alguna sustancia de vital importancia, como en caso de la diabetes, en la que el enfermo no produce insulina, o no lo hace en la cantidad necesaria. A veces, los genes defectuosos son recibidos en herencia, pero en otras muchas ocasiones, como el cáncer, los genes defectuosos los ha desarrollado el propio individuo mediante mutaciones somáticas, por lo que no se puede hablar de enfermedad hereditaria, aunque sí genética. Tradicionalmente, la medicina ha combatido las enfermedades genéticas reponiendo el déficit de la sustancia en cuestión mediante medicamentos. La terapia génica iría más allá, haciendo que el propio paciente fuera el que fabricase su medicamento. Para ello habría que introducir en las células del individuo los genes sanos. Para ello habría que alterar genéticamente algunas células del enfermo.
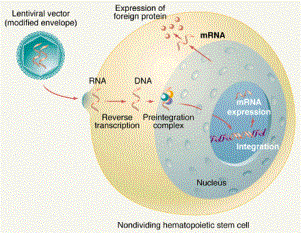
La primera posibilidad de trabajo de la terapia génica sería la terapia in vitro. Se trataría con ella de extraer células del tejido seleccionado de un enfermo, introducir en ellas los genes terapéuticos, cultivar aquellas células que los hubieran aceptado sin problemas, y por último reimplantarlas en el paciente.
La segunda posibilidad sería la terapia in vivo. Con ella, se introducirían directamente en la sangre u otros tejidos del enfermo los vectores (vehículos portadores) con los genes terapéuticos, esperando que se introduzcan en los órganos, tejidos o tumores deseados.
Una variante de la terapia génica es la terapia antisentido que consistiría en la producción de cortos segmentos monocatenarios de ADN que complementarían y anularían los ARN mensajeros mutantes, para que no se produjeran proteínas anómalas y potencialmente dañinas.
El principal problema con el que se ha enfrentado hasta ahora la terapia génica es la inexistencia de un vector ideal y universal. Los ensayos más prometedores parecen apuntar hacia diferentes tipos de virus. Los retrovirus, por ejemplo, introducen sus genes en los cromosomas de las células que invaden de forma permanente, pero carecen de especificidad (infectan muchos tipos de células). Además, los genes se integran en lugares impredecibles de los cromosomas, por lo que podrían ser destruidos genes importantes del enfermo (existiría incluso el riesgo de aparición de tumores). Los adenovirus infectan las células con gran facilidad, y tienden a producir altos niveles de la proteína deseada, pero al no integrar sus genes en los cromosomas, el efecto deseado es temporal, ya que el ADN insertado suele ser destruido al cabo de un tiempo. Otros vectores sobre los que se trabaja son los liposomas (diminutas bolas de lípidos), complejos de ADN-proteína o inyección directa de ADN.
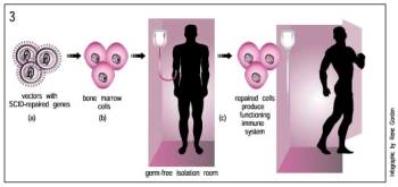
En el año 2002 se produjo el primer éxito
importante de la terapia génica, corrigiéndose una inmunodeficiencia congénita
en dos niños que se habían visto obligados a vivir en una burbuja estéril
durante los primeros meses de su vida. La citada enfermedad, que se caracteriza
por la inexistencia de células NK y de linfocitos T, está originada por la
existencia de un gen defectuoso. El método empleado por los investigadores
franceses fue el de la terapia in vitro. Para ello extrajeron y cultivaron
hemocitoblastos (células madre sanguíneas) de la médula ósea de los
enfermos, y las infectaron con un virus que portaba el gen sano. Las células
que aceptaron el gen, fueron cultivadas y posteriormente introducidas en la médula
ósea de los bebés. En este caso, las células con el gen sano poseen la
propiedad de reproducirse más rápidamente, por lo que en poco tiempo todas las
células madre de los niños poseían la versión correcta del gen. Al cabo de
tres meses los niños abandonaron las burbujas estériles, y actualmente llevan
viviendo en sus casas en torno a un año, presentando ambos un crecimiento y un
desarrollo absolutamente normal. Su sistema inmunitario también parece
funcionar correctamente y ya han recibido sus primeras vacunas.
Sin duda se trató de un éxito formidable, aunque sólo fuera aplicable a un tipo de enfermedad muy concreto. Probablemente pronto aparecerán nuevos anuncios de taras genéticas corregidas. Es cuestión de tiempo. Acaso inspira un cierto recelo la aparente rapidez con la que se producen los ensayos clínicos en humanos. Imaginamos que la investigación está tan avanzada, que pueden realizarse dichos ensayos con seguridad, pero el riesgo de la precipitación existe, y más con los poderosos laboratorios farmacéuticos presionando para hacerse con las patentes de los tratamientos de terapia génica. En este sentido, en Estados Unidos se han llevado a cabo varios ensayos en humanos sin las medidas de seguridad requeridas. El resultado de algunos de ellos ha sido la muerte de los pacientes.