LOS
TRASPLANTES DE ÓRGANOS, EL SISTEMA INMUNITARIO Y LA HERENCIA GENÉTICA.
Los
organismos pluricelulares se deben enfrentar desde su aparición hace más de
600 millones de años a multitud de agentes infecciosos, de manera que hasta los
animales de organización más simple, como poríferos o celentéreos poseen
mecanismos de defensa o inmunitarios.
La primera prueba
que han de superar los virus, bacterias u otros microorganismos patógenos, son
las llamadas barreras externas. En el caso de la especie humana es la piel
impermeable, queratinizada y compuesta externamente de células muertas. Los
conductos internos suelen estar lubricados por secreciones mucosas (tubos
respiratorios, digestivo, etc) que impiden el avance de los microorganismos patógenos.
A veces estos fluidos poseen enzimas que atacan químicamente a los invasores,
como es el caso de las lisozimas de saliva y lágrimas. Otras veces el PH de
algunas mucosas son incompatibles con la vida de muchas bacterias, como el carácter
ácido del interior del estómago o la vagina. Los animales disponemos además
de todo un arsenal de actos reflejos defensivos, como la tos, el vómito, el
estornudo, sin olvidarnos de la propia comunidad de bacterias simbiontes que
coloniza nuestra piel y nuestros conductos internos, que colabora en nuestra
defensa al eliminar competidores.


Si las barreras externas han sido superadas, los
microbios entrarán en nuestros tejidos y se pondrá en marcha la segunda linea
de defensa: la respuesta fagocítica. Unas células sanguíneas llamadas macrófagos,
crecen de tamaño, se activan y comienzan a patrullar, fagocitando células
muertas y agentes infecciosos. Colaboran con ellos otras células, como los
granulocitos neutrófilos o micrófagos. Favorece la acción de los fagocitos la
subida de la temperatura y la dilatación de los vasos sanguíneos donde se
localiza el foco de infección. Esta es la causa de la fiebre y de la inflamación
de las heridas infectadas.
Cuando los dos
mecanismos anteriores (ambos no específicos) no han sido todo lo eficaces que
hubiera hecho falta, la infección progresa y los microorganismos comienzan a
reproducirse en el interior del organismo. Los vertebrados recurrimos entonces a
la respuesta inmunitaria, la más compleja, y sobre todo la más específica:
existe una respuesta distinta para cada tipo de infección.
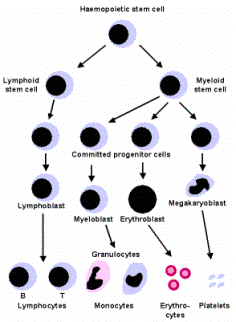
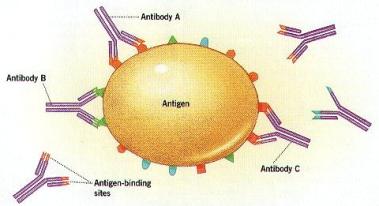
El primer tipo de respuesta inmunitaria es la humoral.
Las células que la protagonizan son los linfocitos B (madurados en la médula
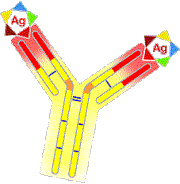
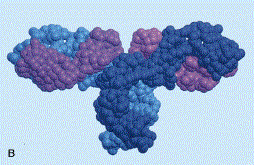
ósea). Básicamente, los linfocitos B producen misiles teledirigidos contra
virus, bacterias y otros parásitos. Dichos misiles reciben el nombre de
anticuerpos, y son diminutas proteínas que se asocian a cualquier sustancia
extraña que entre en el cuerpo, neutralizando, aglutinando o precipitando al
microbio portador. Cada linfocito B produce un solo tipo de anticuerpo, distinto
de los demás, que es capaz de unirse a un tipo de sustancia extraña, distinta
de las demás llamada antígeno. En ausencia de infecciones los linfocitos B son
pequeños y poseen su superficie recubierta del tipo particular de anticuerpo
que pueden fabricar. Cuando ha entrado un agente infeccioso, portará o liberará
algún antígeno, qu tarde o temprano se unirá al receptor de un linfocito B.
Si ello sucede, el linfocito B concreto se activará, se reproducirá
intensamente y liberará masivamente el tipo concreto de anticuerpo. El
mecanismo se conoce como selección clonal.
El segundo tipo de
respuesta inmune es la celular. Es realizada por los linfocitos T (madurados en
el timo). Este tipo de células no liberan anticuerpos, pero poseen como
receptores de superficie unas moléculas parecidas a ellos, capaces también de
reconocer y unirse a multitud de antígenos (o más bien, a fragmentos de
ellos). Cuando esto sucede, se unen a las células portadoras, y les inyectan
enzimas digestivas, matándolas. Este tipo de respuesta es conveniente para
destruir células que ya hospedan a virus en su interior, o para acabar con células
cancerosas. A este tipo de linfocitos se les llama también matadores o citotóxicos.
Hasta aquí se han
comentado los mecanismos del sistema inmunitario, como si sus componentes
actuaran de forma independiente, pero se debe recordar que tal simplificación
es sólo un pálido reflejo de la realidad, ya que lo cierto es que todas las células
a las que hemos hecho referencia colaboran entre ellas y funcionan como un todo
activándose las unas a las otras, o inhibiéndose cuando es preciso, llegando a
formar unos bucles de retroalimentación positiva y negativa verdaderamente
eficaces.
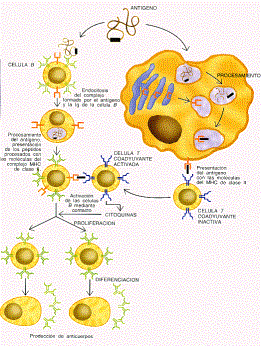
Por ejemplo, los macrófagos no sólo sirven para fagocitar a los microorganismos infecciosos, sino que junto con otros tipos de células, trocean en su interior a los invasores y obtienen de ellos pequeños péptidos (antígenos), que unen a unas moléculas propias (los complejos principales de histocompatibilidad o HLA), y los colocan en la superficie de sus membranas plasmáticas. Al hacer esto, facilitan la activación de los linfocitos T, algunos de los cuales (linfocitos T coadyuvantes) a su vez liberan interleucinas y activan a los linfocitos B. Por esta razón los macrófagos también se denominan células presentadoras de antígenos. El funcionamiento del sistema inmunitario, por lo tanto, se basa en dos principios: reconocimiento de lo extraño y disparo de señales de alarma.
Una vez superada
una infección, son guardadas en “la recámara” numerosas células que han
sido necesarias para vencer al agente infeccioso concreto, de modo que si se
produce una reinfección, las defensas están ya listas y la respuesta inmune es
inmediata. Esta es la causa por la que una misma infección nunca se produce dos
veces. Esta es la causa de la llamada memoria inmune, y es la base para la
utilización de vacunas. Así pues, el sistema inmunitario es capaz de aprender,
sus partes se comunican entre sí y además está dotado de memoria. Es por
tanto un buen candidato a ser considerado un sistema inteligente.
Pero el interés
del estudio del sistema inmunitario va mucho más allá. Es conocido desde hace
cien años que los trasplantes de órganos entre distintas personas no solía
funcionar. Al cabo de pocos días o semanas, el órgano trasplantado solía
morir. En cierto modo el organismo receptor “rechazaba” al órgano o tejido
trasplantado. La causa de los rechazos fue un misterio hasta que no se
conocieron mínimamente los mecanismos con los que actúa el sistema
inmunitario. Se comprendió que una vez trasplantado un órgano, determinadas
moléculas del mismo funcionaban como antígeno, y todas las defensas del
receptor se ponían en marcha para atacar al injerto. Cuando se consiguieron los
primeros medicamentos inmunosupresores, los trasplantes comenzaron a funcionar.
No obstante, se siguió durante un tiempo sin saber cuales eran las moléculas
de los injertos que funcionaban como antígenos. Tales moléculas resultaron ser
los propios HLA de las células del órganos trasplantados.
Los complejos
principales de histocompatibilidad, no están sólo presentes en los macrófagos,
sino en casi todas las células. Son propias de cada individuo y presentan múltiples
versiones. La causa de poseer un HLA de un tipo o de otro es la herencia genética.
Por esta razón no se presenta rechazo en autoinjertos o en trasplantes entre
gemelos, y por esta razón hay menos rechazos entre parientes próximos que
entre personas sin parentesco.
El papel del HLA en
los rechazos a trasplantes está hoy bien documentado. Por ejemplo, en los
trasplantes de riñones se observa una tasa de supervivencia a 10 años de un
50% en el grupo de enfermos en los que se ha podido respetar las reglas de la
histocompatibilidad. La citada tasa es de tan sólo un 30% en los enfermos
trasplantados sin tener en cuenta la similitud de los HLA.
En el año 2002 se
produjo la secuenciación concreta del brazo corto del cromosoma 6, y se destacó
que entre sus muchos genes contiene numerosos de los genes implicados en la síntesis
de los HLA. Tal descubrimiento fue sin duda una buena noticia para el campo de
los trasplantes. En un futuro próximo sería posible catalogar de manera fiable
los órganos listos para trasplante, en función del tipo de HLA del donante,
con vistas a injertarlos sólo en aquellos receptores que presentaran uno
similar. Se reduciría de este modo el riesgo de rechazos, y se podría
disminuir las dosis de fármacos inmunosupresores en trasplantados, acabando por
tanto con el riesgo de infecciones oportunistas.